清華新聞網10月24日電 表觀遺傳信息尤其是異染色質相關修飾能在細胞代間穩定傳遞,以此維持細胞命運的穩定性。在哺乳動物配子向早期胚胎轉換的過程中,細胞命運發生劇烈重置,同時伴隨著大規模的表觀遺傳重編程。盡管相關重編程圖譜已被逐步繪制,但重編程過程中關鍵調控因子的鑒定及其調控機制仍是領域內亟待解決的關鍵問題。
10月20日,清華大學生命學院頡偉研究組在《細胞·干細胞》(Cell Stem Cell)發表了題為“EZHIP限制PRC2非經典結合并調控H3K27me3代間繼承和重編程”(EZHIP restricts noncanonical PRC2 binding and regulates H3K27me3 intergenerational inheritance and reprogramming)的研究論文。該研究在小鼠早期胚胎中鑒定出EZHIP(EZH inhibitory protein)是一個關鍵的表觀遺傳重編程因子,它控制了代間H3K27me3修飾的多層次重編程,包括全基因組范圍內該修飾的擦除與重建,以及非經典印記表觀記憶的傳遞。
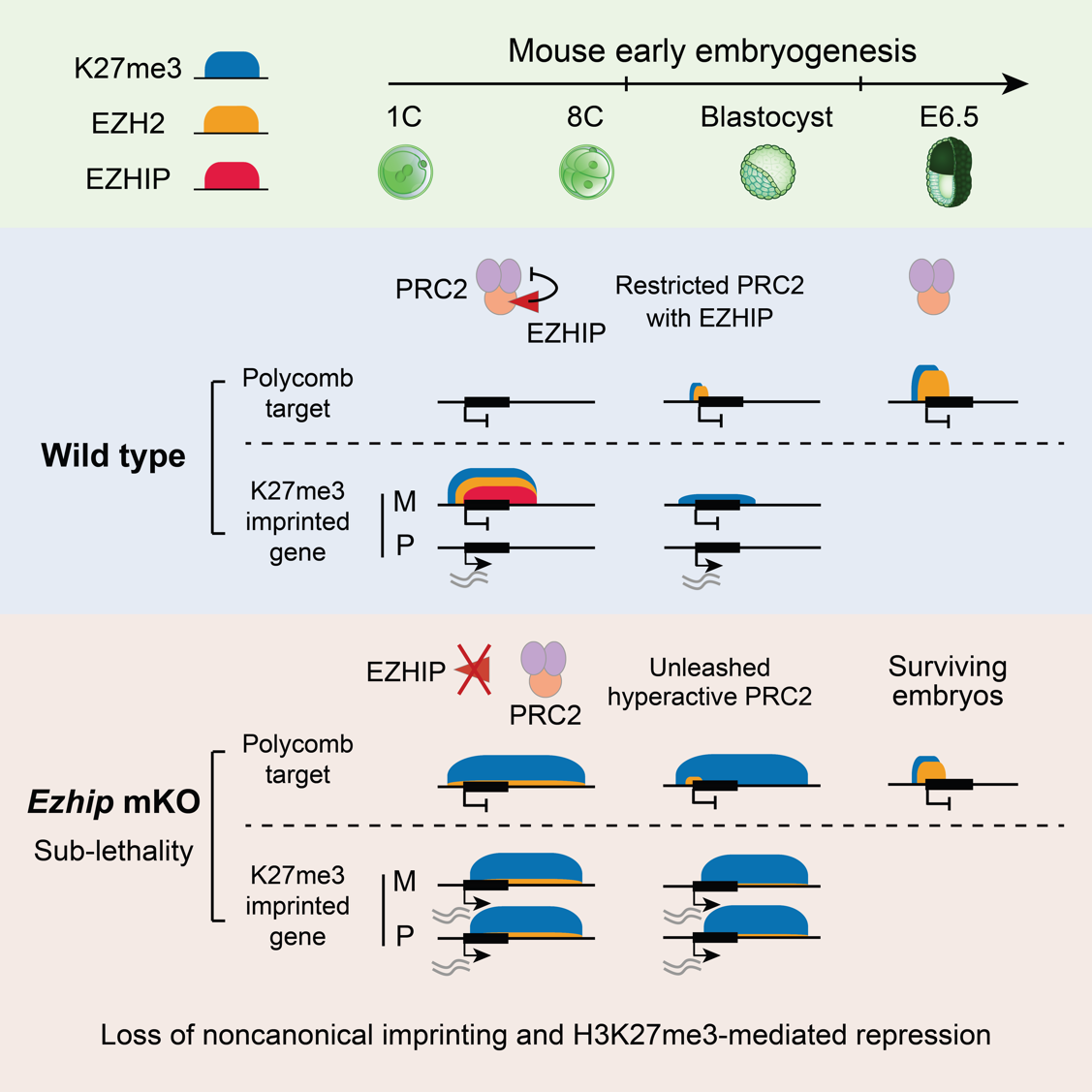
H3K27me3是一種重要的抑制性組蛋白修飾,由PRC2(多梳復合物2)催化。在小鼠代間重編程中,H3K27me3呈現出高度動態變化。在卵母細胞中,H3K27me3分布于經典的發育基因啟動子區域(稱為多梳靶基因區域),同時也出現在基因間區,占據經常超過上百kb的區域(稱為非經典H3K27me3結構域)。受精后,經典的H3K27me3在發育基因啟動子處被快速擦除,直至著床前后才發生重建。然而非經典H3K27me3結構域在受精后仍能保留,并在著床前發育過程中短暫維持。為什么H3K27me3在代間重編程過程中在一些區域發生重置,同時在另一些區域發生遺傳?這其中的調控因子是什么?
為解答這些問題,研究團隊首先鑒定了卵母細胞與早期胚胎發育過程中PRC2的染色質結合區域。研究團隊發現,在生長階段的卵母細胞中,PRC2同時結合在多梳靶基因區域和非經典H3K27me3區域,活躍地催化H3K27me3修飾。然而在完全生長期的卵母細胞(FGO)中PRC2與染色質發生解離。受精后,PRC2在一細胞晚期重新出現在染色質上,并結合在非經典H3K27me3結構域。直至囊胚時期,PRC2才重新定位至多梳靶基因區域,啟動H3K27me3的重建。
EZHIP調控PRC2非經典染色質結合和H3K27me3代間重編程
研究團隊進一步證明,EZHIP在早期胚胎中調控PRC2非經典染色質結合與H3K27me3代間重編程。EZHIP是一種內源性PRC2抑制因子,僅在生殖細胞中特異性表達,而在其他細胞類型中被DNA甲基化沉默。研究團隊發現Ezhip mRNA在卵母細胞中大量積累,但處于翻譯抑制狀態。Ezhip僅在受精前后兩天被活躍翻譯,從而在著床前胚胎中表達豐度極高的蛋白。
有趣的是,野生型胚胎中親本來源的H3K27me3不對稱性能維持到囊胚階段,并介導非經典基因印記記憶;而EZHIP缺失后,H3K27me3不對稱性在二細胞階段已經完全喪失,導致非經典基因印記隨之丟失。進一步的機制研究表明,著床前胚胎中EZHIP與PRC2能夠共同結合在非經典H3K27me3結構域,在染色質上形成H3K27me3-PRC2-EZHIP復合體,以此限制PRC2的酶活和擴散。EZHIP缺失后,PRC2不再被限制,繼而在全基因組大部分區域催化了H3K27me3修飾,掩蓋了幾乎所有親本來源的H3K27me3記憶。與常規認知相悖的是,這種廣泛分布的H3K27me3修飾并未引起全局性基因沉默,反而讓H3K27me3喪失了原本的抑制功能,導致非經典印記基因的異常激活和印記X染色體失活的失調。這可能是因為H3K27me3的效應因子(例如PRC1和PRC2)被大量出現的H3K27me3稀釋,無法有效富集在正確的靶基因區域,從而導致基因抑制功能失效。另外,EZHIP缺失所造成的H3K27me3在全基因組范圍內的過度積累還阻礙了后續多梳靶基因區域H3K27me3的重建,并伴隨著胚胎植入后部分致死現象。
綜上,研究揭示了EZHIP是早期胚胎中關鍵的表觀遺傳重編程因子,調控了H3K27me3代間重編程的擦除、遺傳和重建。同時,這些發現揭示了表觀遺傳記憶傳遞的基本原則,即異染色質相關酶活過低或者過高,均會導致表觀遺傳記憶和基因抑制功能的喪失。
清華大學生命科學學院教授頡偉為論文通訊作者,生命科學學院2019級博士生曾埶天、2022級博士生孔鳳為論文共同第一作者。
研究得到國家自然科學基金委員會、國家科技部重點研發計劃、清華-北大生命科學聯合中心和中國博士后科學基金的經費支持。
論文鏈接:
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(25)00340-6
供稿:生命學院
編輯:李華山
審核:郭玲